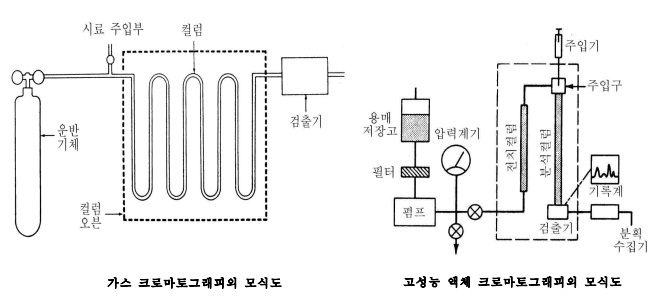
개요
크로마토그래피에서는 주로 휘발성물질을 대상으로 하고 있었으나,1952년 마틴과 제임스가 기체나 휘발성물질을 대상으로 하는, 소위 기체 크로마토그래피를 개발한 이후, 이 방법은 획기적인 분석법으로 다양한 분야에 응용되고 있다. 원리는 그 이전부터 실시되어 온 액체 크로마토그래피와 동일하지만, 이동상에 기체를 사용하기에 다음과 같은 특징을 가지고 있겠다.
① 액체에 비해 기체는 점성이 훨씬 작아서, 긴 관을 사용할 수 있기에 분리능이 크다.
② 정지상, 이동상 속에서 시료성분의 확산하는 속도가 크므로 분석시간이 짧다.
③ 이동상 속에서 성분농도의 연속적인 측정이 가능하고, 쉽게 자동으로 기록할 수 있다.
기체 크로마토그래피는, 액체 크로마토그래피와 같이 정지상으로 액체를 사용하는 기체-액체 분배 크로마토그래피와 흡착능을 갖는 고체를 사용하는 기체-고체 흡착 크로마코그래피로 분류할 수 있다.
전자는 규조토와 같은 담체에다 비등점이 높은 액체, 또는 사용 온도에서 액화되는 고체를 함침한 것을 관에 충전하여 정지상으로 사용하며, 이곳을 시료 성분 분자가 운반기체와 함께 이동할 때, 그 일부는 액체에 용해되어 분배평형에 이르게 된다. 시료는 이 분배평형을 반복하면서 컬럼 속을 흐르고 분배계수가 작은 것부터 순차적으로 분리되어, 컬럼의 출구에 도달하게 된다. 이 컬럼의 출구에서의 농도 변화를 열전도도 검출기 등으로 측정하여 이것을 기록함으로써 시료 속의 성분을 알게 된다. 후자는 활성탄, 알루미나, 실리카겔 분자체 등과 같이 흡착활성이 큰 고체를 정지상으로, 사용하는 것으로서 무기 및 탄화수소 기체 등의 분석에 사용되지만, 극성이 큰 성분은 강하게 흡착되므로 분리가 곤란하다. 이에 비해 기체-액체 크로마토그래피는 아주 많은 종류의 액상 성분을 선택할 수 있으므로, 많은 유기화합물의 분리 분석에 광범위하게 응용되고 또한 이 액체 성분을 가는 모세관에 도포한 것을 정지상으로 사용함으로써 극미량 성분을 효율적으로 분석할 수 있는 이로운 점을 지니고 있다.
기체 크로마토그래피 분석법을 응용한 분야에는 분해 생성물을 분석하여 원물질을 확인하는 열분해 기체 크로마토그래프법, 분리된 미량 성분을 포집하여 적외선 분광기 등의 시료로 하는 분취 기체 크로마토그래프법, 비등점 범위가 넓은 시료를 짧은 시간에 분석하는 승온 기체 크로마토그래프법, 질량분석계와 직접 연결한 GC-Mass법, 화학공정 중에 설치하여 제품의 품질관리를 하는 공정 기체 크로마토그래프법 등, 기기분석법으로서 그 이용 범위가 아주 넓다.
기초 이론
머무름값과 분배계수와의 관계
GC에서의 분리는 운반기체와 고정상 액체의 두 상에 대한 각 시료 성분의 분배계수의 차에 따라 이루어진다. 두 상 사이에서 성분 i의 분배계수 Ki는 다음과 같이 정의되며, 온도가 일정하면 각 성분마다 고유한 값을 갖는다.

일정 유속의 운반기체에 의해 시료주입구로부터 분리컬럼 입구에 도입된 혼합시료 중의 각 성분은 Ki값에 따라 고정상 액체와 운반기체 사이에서 분배 평형을 반복하면서 운반기체의 흐름에 따라 분리컬럼을 통과하는 동안에, Ki값이 작은 성분은 빨리 유출되며 Ki값이 큰 성분은 시간적으로 지연됨에 따라 분리가 이루어진다. 고정상 액체를 고정상 흡착체에 대하여 분배평형을 흡착평형으로 대치하면 똑같은 원리를 GSC에도 적용할 수 있다.
단이론과 이론단수
크로마토그래프 분리는 많은 점에서 증류분리와 유사하다. 그러므로 Martin은 크로마토그래프의 분리효율을 이론단수로 나타내고, 이것을 추정하였다. 이론단수는 단일 성분을 미량의 공기 기포와 함께 관에 주입함으로써 측정할 수 있다. 이렇게 하여 얻어진 대표적인 크로마토그램을 그림 1-1에 도시하였다.

▲ 그림 1-1. 단일 성분의 크로마토그램 (시료의 유출에 필요한 시간과 공기 유출에 필요한 시간의 차이는 X성분이다.)
공기가 유출되기까지 소요된 시간 = T분
시료가 유출되기까지 소요된 시간 = (T + X)분
시료 피크가 검출기를 통과하는 데 소요된 시간 = Y분
실험에서 관측된 용출곡선에서 이론단수를 다음 식에 의해 계산할 수 있다.
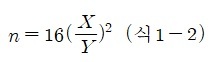
이 계산식에서 공기는 액체의 정지상과는 상호작용을 하지 않는다고 가정한다. 그러므로 공기는 액체의 정지상 중에 머무르지 않고 컬럼을 최단시간 내에 통과한다. 이 시간을 불감시간이라 칭하며, 시료성분이 정지상과 상호작용하지 않고 분리관을 통과하는 데 몇 분 걸리는가를 추측하는 척도가 된다. X분은 시료가 컬럼내에 여분으로 머물고 있는 시간이다. 시료는 이 시간만큼 정지상에 머무르고 있다. Y분은 시료가 검출기를 통과하고 있는 시간을 나타낸다. 이것은 시료가 컬럼 내를 이동할 때 얼마만큼 확산되었는가를 직접적으로 나타내는 척도가 된다.
물론 식 1-2로 계산한 이론단수는 컬럼을 만드는 방법에 따라 변할 뿐만 아니라 시료의 성질, 유속, 온도 및 시료 도입 방법, 기타 여러가지 조건의 변화에 따라 좌우되므로 단수 내지 이론단수의 높이는 관 효율의 표시방법이며, 개략적으로 비교하기 위한 수치에 불과하다. 가령 180cm 길이인 관의 이론단수는 다음과 같이 계산된다.
[예제 1-1]
공기 피크의 최대값이 얻어지기까지 소요된 시간 = 1분
시료 피크의 최대값이 얻어지기까지 소요된 시간 = 5분
시료 피크가 검출기를 통과하는 시간 = 1/2분
이론 단수 n은

실제로는 이론단수의 높이(HETP)를 나타내는 것이 더 의미가 있다. 즉 는 다음 식으로 주어진다.
HETP = 컬럼의 길이/이론단수 = L/n, L: 컬럼의 길이, 위의 예제에서 사용한 컬럼의 데이타를 쓰면 HETP는 180/1024 = 0.176cm 로 된다.
'기타' 카테고리의 다른 글
| 기체 크로마토그래피(3), 머무름 값을 결정하는 요소 (0) | 2023.02.18 |
|---|---|
| 기체 크로마토그래피(2), Van Deemter equation (0) | 2023.02.18 |
| 기능성 남성 화장품 '스케다 SKEDA 올인원' (0) | 2023.02.18 |
| 깔끔대장 강력한 세탁기용 곰팡이제거제 '클린젤' (0) | 2023.02.18 |
| 각질케어 에센스 크림 - 메디아하 크림 (1) | 2023.02.18 |




댓글